当天,国度药监局发布对于愉快在北京上海开展优化变嫌药临床磨真金不怕火审评审批试点的批复:经审核,愉快在北京、上海开展优化变嫌药临床磨真金不怕火审评审批试点。这亦然自优化变嫌药临床磨真金不怕火审评审批试点责任决策印发以来首批过审的试点区域。
日前,国度药监局印发优化变嫌药临床磨真金不怕火审评审批试点责任决策的奉告。奉告要求,优化变嫌药临床磨真金不怕火审评审批机制,强化药物临床磨真金不怕火苦求东谈主主体包袱,升迁药物临床磨真金不怕火相干方对变嫌药临床磨真金不怕火的风险识别妥协决才气,探索竖立全面升迁药物临床磨真金不怕火质地和效力的责任轨制和机制,实现30个责任日内完成变嫌药临床磨真金不怕火苦求审评审批,裁汰药物临床磨真金不怕火初始用时。
从奉告纳入试点责任践诺模式来看,共分为“试点区域苦求”“试点机构苦求”“试点神色苦求”“审评审批”“初始践诺药物临床磨真金不怕火”五步。这次北京、上海获批试点区域,只是只是践诺试点责任的第一步。
在此之后,当地临床磨真金不怕火机构需竖立完善相干责任轨制,向场所地省级药品监督解决部门建议试点苦求,省级药品监督解决部门审核说明。
若当地临床磨真金不怕火机构相宜要求,相宜要求的苦求东谈主可自发报告试点神色。试点区域省级药品监督解决部门商药审中心,在收到试点苦求后5个责任日内向愉快推选的试点神色苦求东谈主发送神色说明书并抄送试点机构,反之则不纳入试点。
经说明的试点神色,药审中心在受理临床磨真金不怕火苦求后30个责任日内完成审评审批,并通过药审中心网站奉告苦求东谈主审批收尾。
终末,苦求东谈主与试点机构开展高效合营,于临床磨真金不怕火苦求获批后12周内初始临床磨真金不怕火(第一例受试者签署知情愉快书),并在临床磨真金不怕火全经由践诺风险解决。
原标题:集泰股份:累计回购股份1276600股
从技术安排及预期效果来看,这次北京、上海试点责任将为期一年,且需至少完成10个品种的临床磨真金不怕火苦求审评审批并初始临床磨真金不怕火。试点责任将于2025年1月开展中期评估,并于2025年7月纪念试点责任西宾。
▌国内变嫌药或迎“加快”场所
值得小心的是,这次试点神色为1类变嫌药(细胞和基因治愈家具、疫苗家具等之外)临床磨真金不怕火苦求。1类变嫌药是国内生物医药研发最高水平的代表,其需知足境表里均未上市的前置要求,且含有新的结构明确的、具有药理作用的化合物,同期具有临床价值。
连年来,我国药物研发插足力度握续增强。公开数据自大,从2018年到2023年,国内上市药企TOP50研发插足总数从371.6亿元攀升至883亿元,年复合增长率超15%。
其收尾是,连年来国内变嫌药磨真金不怕火报告数目逐年高潮。2023年度中国CDE药品审评讲述自大,2019年中国变嫌化学药品的IND受理品种为552个,而2023年中国变嫌化学药品的IND受理品种高达1368个,相较2022年呈较大增长。其中,据药智网统计,2023年1类变嫌药的IND受理品种为1241个。
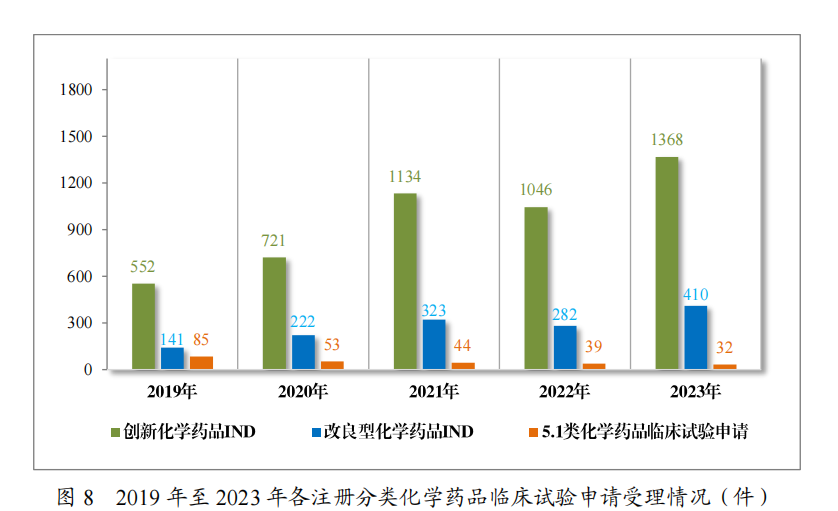
图源:国度药品监督解决局
在国内药物研发握续扩大的配景下,国内每每涌现撑握变嫌药发展相干策略:
7月5日,李强主握召建国务院常务会议,审议通过《全链条撑握变嫌药发展践诺决策》。会议指出,要全链条强化策略保障,统筹用好价钱解决、医保支付、买卖保障、药品配备使用、投融资等策略,优化审评审批和医疗机构傍观机制,协力助推变嫌药冲突发展。
7月30日,上海市东谈主民政府办公厅发布《对于撑握生物医药产业全链条变嫌发展的多少主见》。其中建议,握续加大变嫌药研发撑握力度。对由我市注册苦求东谈主开展国内Ⅰ期、Ⅱ期、Ⅲ期临床磨真金不怕火并实现产出的1类新药,按照规范对不同阶段择优予以不跨越研发插足的40%,最高分离1000万元、2000万元、3000万元撑握;对其中仅需完成早期临床磨真金不怕火、确证性临床磨真金不怕火的细胞与基因治愈1类新药,按照规范择优予以最高分离1500万元、3000万元撑握。每个单元每年累计撑握金额最高1亿元。
中泰证券7月研报指出,自2023下半年起,针对国内变嫌药产业发展的利好策略频出,从审评提速、多元支付、合理订价等多维度作念到了娇傲扶握;2024年以来,北京、广州、珠海同期发布撑握医药变嫌发展的策略或征求主见稿,各地对变嫌药产业撑握策略正缓缓落地。后续有望看到更多配套落地策略开yun体育网,激励变嫌药企业的活力,建议重心变嫌药宽恕盈利收场和出海赛谈。